Summary.
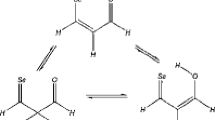
Rotational isomers of ten 2,6-disubstituted phenols containing two different carbonyl substituents (COOH, COOCH3, CHO, COCH3, CONH2) have been investigated theoretically with the aid of DFT methods (B3LYP/6-31G(d,p)). The relative stabilities of four to five conformers of each compound were determined by full geometry optimizations for the free molecules and, in order to simulate solvent effects, also for molecules in reaction fields with dielectric constants up to ɛ=37.5. Comparison with available experimental IR spectroscopic data revealed excellent agreement with the theoretically predicted stability sequences and conformational equilibria. The two determinative energy contributions, that of the attractive intramolecular hydrogen bond interactions and that of the (mostly repulsive) interactions between the phenolic oxygen atoms and the other non-hydrogen-bonded carbonyl substituents, were separately calculated from isodesmic reactions (benzoyl compound + phenol ⇌ 2-hydroxybenzoyl compound + benzene). The stability sequences of the conformers, as obtained from the sum of each two energy contributions, almost exactly comply with the sequences obtained from the full geometry optimizations. With all compounds the conformation of the most stable isomer is determined by the energetically most favourable non-bonded O⋯R*C interaction and not by the more favourable one of the two possible O*HċċO*C H-bond interactions.
Zusammenfassung.
Die strukturellen, energetischen und spektroskopischen Eigenschaften der Rotationsisomeren von zehn unsymmetrisch substituierten 2,6-Dicarbonylphenolen (COOH, COOCH3, CHO, COCH3, CONH2) wurden mit DFT-Methoden (B3LYP/6-31G(d,p)) untersucht. Die relativen Stabilitäten von vier bis fünf Konformeren jeder Verbindung wurden durch Geometrieoptimierungen einerseits der freien Moleküle und andererseits, um auch Lösungsmitteleffekte zu berücksichtigen, in Reaktionsfeldern mit Dielektrizitätskonstanten bis zu ɛ=37.5 bestimmt. Vergleiche mit experimentellen IR-spektroskopischen Daten zeigen eine vortreffliche Übereinstimmung mit den theoretisch vorhergesagten Stabilitätssequenzen und Konformationsgleichgewichten. Die beiden entscheidenden Energiebeiträge, jene der Wasserstoffbrückenbindungen und jene der (zumeist abstoßenden) Wechselwirkungen zwischen den phenolischen Sauerstoffatomen und den nicht wasserstoffbrückengebundenen Carbonylsubstituenten, wurden mit Hilfe von isodesmischen Reaktionen berechnet (Benzoyl-Verbindung + Phenol ⇌ 2-Hydroxy-benzoyl-Verbindung + Benzol). Die aus den Summen der beiden Beiträge ermittelten Stabilitätssequenzen stimmen nahezu exakt mit jenen überein, die bei den vollständigen Geometrieoptimierungen erhalten wurden. In allen Fällen wird die Konformation des stabilsten Isomers durch die energetisch günstigste O⋯R*C-Wechselwirkung bestimmt und nicht durch die günstigere der beiden möglichen O*HċċO*C-Wasserstoffbrückenbindungen.
Similar content being viewed by others
Author information
Authors and Affiliations
Additional information
Received December 10, 1998. Accepted (revised) January 12, 1999
Rights and permissions
About this article
Cite this article
Simperler, A., Mikenda, W. Competitive Hydrogen Bonds and Conformational Equilibria in 2,6-Disubstituted Phenols Containing two Different Carbonyl Substituents. Monatshefte fuer Chemie 130, 1003–1016 (1999). https://doi.org/10.1007/PL00010277
Published:
Issue Date:
DOI: https://doi.org/10.1007/PL00010277