Abstract
Rhodeus amarus acclimated to 10° or 20°C die at 31.7° or 36.4°C, respectively (cessation of operculum movements). After raising the adaptation temperature (AT) from 10° to 20°C, adaptation is complete after 8 days. The toxicity of actinomycin D, injected intraperitoneally, is AT-dependent (e.g. at 5°C, LD50–7 days=0.8 μg/g fish; at 25°C, LD50–7 days=0.35 μg/g fish). In the following experiments 0.5 μg actinomycin/g fish were used. After actinomycin-injection, RNA-values in white dorsal muscle decreased about 50% within 12 h and the values of control individuals were finally attained after 16 days. Following an AT-change from 10° to 20°C, DNA-values in the white dorsal muscle increased about 10%, RNA-values about 30%, within 12 h. However, in fish injected intraperitoneally with actinomycin, no increase in DNA or RNA was noticed. Actinomycin injection per se causes increased heat resistance. This process lasts 10 days. If AT is raised now from 10° to 20°C, the new resistance level is reached later. The control fish gain resistance at a rate of about 1 C°/day during the first days after the temperature change. Actinomycin-treated individuals, however, exhibit an increase of 0.25 C°/day. Inhibition of resistance adaptation due to proteinbiosynthesis-inhibitors supports the view that protein synthesis is of importance for adjustments in heat resistance of intact animals.
Zusammenfassung
-
1.
Bitterlinge (Rhodeus amarus), die an 10° bzw. 20°C angepaßt sind, zeigen — an der ”Kiemendeckel-Stillstands-Temperatur” gemessen — ein Resistenzniveau von 31,7° bzw. 36,4°C. Wird die Adaptations-temperatur (AT) von 10° auf 20°C erhöht, so ist die Anpassung nach etwa 8 Tagen beendet.
-
2.
Dosis-Letalitäts-Kurven, bei den ATs von 5° und 25°C aufgenommen, weisen daraufhin, daß die Giftigkeit des Actinomycins, welches intraperitoneal injiziert wurde, mit der AT ansteigt (z. B. LD 5°C50 =0,8μg/g Fisch; LD 25°C50 =0,35 μg/g Fisch; Beobachtungszeit jeweils 7 Tage). Bei allen folgenden Versuchen wurde mit einer Dosis von 0,5 μg/g Fisch gearbeitet.
-
3.
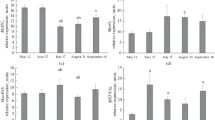
Die DNA-Konzentration im Rückenmuskel wird durch Actinomycin nicht wesentlich verändert. Auch die AT hat keinen erkennbaren Einfluß. Dagegen findet man nach einer Actinomycin-Injektion die RNA im Rückenmuskel innerhalb von 12 Std um 50% erniedrigt. 16 Tage nach der Injektion beginnt die Normalisierung der Werte.
-
4.
Bei einem AT-Wechsel von 10° nach 20°C zeigen die DNA-Werte nach 12 Std einen 10%igen anstieg und die RNA-Werte sogar einen 30%igen. Bei den mit Actinomycin gespritzten Tieren findet sich kein solcher Anstieg. Der Gehalt des Rückenmuskels an lôslichen Proteinen wird durch Actinomycin schwach (10%) erniedrigt.
-
5.
Schon eine Actionmycin-Injektion allein führt zu einer Hitzeresistenzerhöhung. Nach 10 Tagen ist dieser Effekt abgeklungen. Wird nun die AT von 10° auf 20°C erhöht, so wird das neue Resistenzniveau verzögert erreicht. Die Kontrolltiere haben in den ersten Tagen nach dem Temperaturwechsel einen Resistenzgewinn von 1 C°/Tag, die “Actinomycin-Tiere” zeigen dagegen einen Wert von 1/4 C°/Tag.
-
6.
Ein solcher Nachweis der Hemmung der Resistenzadaptation durch Proteinbiosynthese-Inhibitoren spricht dafür, daß den Proteinen für die Hitzeresistenz und-adaptation der intakten Tiere direkt oder indirekt eine besondere Bedeutung zukommt.
Similar content being viewed by others
Zitierte Literatur
Beisenherz, G., H. J. Boltze, Th. Bücher, R. Czok, K. H. Garbade, E. Meyer-Arendt und G. Pfleiderer: Diphosphofructose-Aldolase, Phosphoglyceraldehyd-Dehydrogenase, Milch säure-Dehydrogenase, Glycerophosphat-Dehydrogenase und Pyruvat-Kinase aus Kaninchenmuskel in einem Arbeitsgang. Z. Naturf. 8b, 555–577, (1953).
Bowler, K.: A study of factors involved in acclimatization to temperature and death at high temperatures in Astacus pallipes. II. Experiments at the tissue level. J. cell. comp. Physiol. 62, 110–132 (1963).
Brandts, J. F.: Heat effects on proteins and enzymes. In: Thermobiology, pp 25–72. Ed. by A. H. Rose, London, New York: Academic Press 1967.
Braun, A. D., N. M. Nesvetayeva and N. V. Fizhenko: The relation between resistance of cells and tissues to damage and denaturation capacity of proteins. In: The cell and environmental temperature, pp 344–350. Ed. by A. S. Troshin. Oxford: Pergamon Press 1967.
Brett, J. R.: Some lethal temperature relations of Algonquin Park fishes. Publs Ont. Fish. Res. Lab. 63, 1–49 (1944).
—: Rate and gain of heat tolerance in goldfish. Publs Ont. Fish. Res. Lab. 64, 9–28 (1946).
— Some principles in the requirements of fishes. Q. Rev. Biol. 81, 75–87 (1956).
—: Temperature: animals — fishes. In: Marine ecology. Vol. I. Environmental factors, Part 1. pp 515–560. Ed. by O. Kinne. London: Wiley 1970.
Brockmann, H.: Die Actinomycine. Fortschr. Chem. org. NatStoffe 18, 1–12 (1960).
Burton, K.: A study of the conditions and mechanism of the diphenylamine reaction for colorimetric estimation of deoxyribonucleic acid. Biochem. J. 62, 315–323 (1956).
Cerf, I. A., L. S. Otis and S. F. Tagaki: Reversible heat block of electrical activity in the goldfish brain. Am. J. Physiol. 192, 453–456 (1958).
Cocking, A. W.: The effect of high temperatures on the roach (Rutilus rutilus). J. exp. Biol. 36, 203–216 (1959).
Colhoun, E. H.: Acclimatization to cold in insects. Entomology exp. appl. 3, 27–37 (1960).
Dickie, L. M.: Effects of high temperature on survival of giant scallop. J. Fish. Res. Bd Can. 15, 1189–1211 (1958).
Dingley, F. and J. M. Smith: Temperature acclimatization in absence of protein synthesis in Drosophila subobscura. J. Insect. Physiol. 14, 1185–1195 (1968).
Dische, Z.: Über einige neue charakteristische Farbreaktionen der Thymonukleinsäure und eine Mikromethode zur Bestimmung derselben in tierischen Organen mit Hilfe dieser Reaktion. Mikrochemie 8, 4–32 (1930).
Fraenkel, G. S. and G. V. Herford: The physiological action of abnormally high temperatures on poikilotherm animals. II. The respiration at high sublethal and lethal temperatures. J. exp. Biol. 17, 386–395 (1940)
Freeman, J. A.: Oxygen consumption, brain metabolism and respiratory movements during temperature acclimatization, with special reference to lowered temperatures. Biol. Bull. mar. biol. Lab., Woods Hole 99, 416–424 (1950).
Frisen, L.: Reliability of intraperitoneal injections in fish. Experientia 23, 793–888 (1968)
Fry, F. E. I.: The lethal temperature as a tool in taxonomy. Année biol. 33, 205–219 (1957).
Furch, K.: Der Einfluß einer Vorbehandlung mit konstanten und wechselnden Temperaturen auf die Hitzeresistenz von Gammarus salinus und Idotea balthica. Mar. Biol. 15, 12–34 (1972).
Grainger, J. N. R.: Heat death in Arianta arbustorum. Comp. Biochem. Physiol. 29, 665–670 (1969).
Gronow, G.: Untersuchungen über Stress-Effekte auf Enzymaktivitäten, Nukleinsäure- und Substratgehalte in der dorsalen Rumpfnuskulatur einiger Teleosteer. (In Vorbereitung).
Hartmann, G., W. Behr, K.-A. Beissner, K. Honickel und A. Sippel: Antibiotica als Hemmstoffe der Nucleinsäure- und Proteinsynthese. Angew. Chem. 18, 710–718 (1968).
Hutchinson, V. H.: Critical thermal maxima in salamanders. Physiol. Zoöl. 34, 92–125 (1961).
Kersten, W., H. Kersten, H. Wanke und A. Ogilvie: Einfluß von Antibiotika auf Nucleinsäuren und den Nucleinsäurestoffwechsel. Zentbl. Bakt. Parasitkde [I. Abt. Orig.] 212, 259–265 (1970)
Kirberger, Ch.: Untersuchungen über die Temperaturabhängigkeit von Lebensprozessen bei verschiedenen Wirbellosen. Z. vergl. Physiol. 35, 175–198 (1953).
Laudien, H.: Über die Wirkung von Actinomycin D auf die Temperaturresistenz des Cilienepithels der Fühler von Planorbiden. Zool. Anz. (Im Druck).
Lehmann, J.: Veränderungen der Enzymaktivitäten nach einem Wechsel der Adaptationstemperatur, untersucht am Seitenrumpfmuskel des Goldfisches (Carassius auratus L.). Int. Revue ges. Hydrobiol. 55, 763–781 (1970).
Levins, R.: Thermal acclimation and heat resistance in Drosophila species. Am. Nat. 103, 483–499 (1969).
Licht, P.: Thermal adaptation in the enzymes of lizards in relation to preferred body temperatures. In: Molecular mechanisms of temperate adaptation, pp 131–145. Ed. by C. L. Prosser. Washington D.C.: American Association for the Advancement of Science 1967.
Marek, M.: Effect of Actinomycin D on synthesis of “cooling protein” in haemolymph of pupae of Galleria mellonella L.. Comp. Biochem. Physiol. 34, 221–227 (1970a).
— Effect of stress of cooling on the synthesis of immunoglobulins in haemolymph of Galleria mellonella L. Comp. Biochem. Physiol. 35, 615–622 (1970b).
McLeese, D. W.: Effects of temperature, salinity and oxygen on the survival of the American lobster. J. Fish. Res. Bd Can. 13, 247–272 (1956).
Mejbaum, W.: Über die Bestimmung kleiner Pentosemengen insbesondere in Derivaten der Adenylsäure. Hoppe-Seyler's Z. physiol. Chem. 258, 117–120 (1939).
Mews, H.-A.: Über die Temperaturadaptation der Sekretio von Verdauungsfermenten und deren Hitzeresistenz. Z. vergl. Physiol. 40, 345–355 (1957).
Milkman, R.: Kinetic analysis of temperature adaptation in Drosophila pupae. In: Molecular mechanisms of temperature adaptation, pp 147–162. Ed. by C. L. Prosser. Washington D.C.: American Association for the Advancement of Science 1967.
Ohsawa, W. and H. Tsukuda: Composition and heat tolerance of serum protein of goldfish acclimated to different temperatures. J. Inst. Polytech. Osaka Cy Univ. (Ser. D) 15, 31–38 (1964).
Okasha, A. Y. K.: Effects of high temperature in Rhodinus prolixus (Stål). Nature, Lond. 204, 1221–1222 (1964).
Precht, H.: Der Einfluß der Temperatur auf Lebensprozesse. Der Einfluß extremer Temperaturen In. Temperatur und Leben, pp 43–80. Hrsg. von H. Precht, J. Christophersen und H. Hensel, Berlin: Springer Verlag 1955.
—: Untersuchungen über die Resistenzadaptation einiger Organfunktionen von Warmwasserfischen gegenüber extremen Temperaturen. Z. vergl. Physiol. 42, 365–382 (1959).
—: Anpassungen wechselwarmer Tiere zum Überleben extremer Temperaturen. Naturw. Rdsch., Stuttg. 16, 9–16 (1963).
—: Anpassungen wechselwarmer Tiere im normalen Temperaturbereich und ihre Ursachen. Naturw. Rdsch., Stuttg. 17, 438–442 (1964).
—: A survey of experiments on resistance-adaptation. In: The cell and environmental temperature, pp 307–321. Ed. by A. S. Troshin. Oxford: Pergamon Press 1967.
— T. Basedow, R. Berek, F. Lange, W. Thiede und L. Wilke: Reaktionen und Adaptationen wechselwarmer Tiere nach einer Änderung der Anpassungstemperatur und der zeitliche Verlauf. Helgoländer wiss. Meeresunters. 13, 369–401 (1966).
— und J. Christophersen: Temperaturadaptation des Cilienepithels isolierter Kiemen und Fühlerspitzen von Mollusken. Z. wiss. Zool. 171, 197–209 (1965).
Precht, H. J., Christophersen and H. Hensel. Temperature and life. 2. Ed. Berlin: Springer Verlag. (Im Druck).
Read, K. R.: Thermostability of proteins in poikilotherms. In: Molecular mechanisms of temperature adaptation, pp 93–106. Ed. by C. L. Prosser, Washington D.C.: American Association for the Advancement of Science 1967.
Reich, E.: Biochemistry of actinomycines. Cancer Res. 2312, 1428–1429 (1963).
Roberts, D. W. A.: Some possible roles for isozymic substitutions during cold hardening in plants. Int. Rev. Cytol. 26, 303–328 (1969).
Rosenberg, B., G. Kemeny, R. C. Switzer T. C. Hamilton: Quantitative evidence for protein denaturation as the cause of thermal death. Nature, Lond. 232, 471–473 (1971).
Schlieper, C. und R. Kowalski: Über den Einfluß des Mediums auf die thermische und osmotische Resistenz des Kiemengewebes der Miesmuschel Mytilus edulis. Kieler Meeresforsch. 12, 37–45 (1956).
Skramlik, E. v.: Der Vagusschock. Jena. Z. Med. Naturw. 78, 208–218 (1947).
Somero, G. N.: Pyruvate kinase variants of the Alaskan king crab. Evidence for a temperature-dependent interconversion between two forms having distinct kinetic and adaptive properties. Biochem. J. 114, 237–241 (1969).
Spoor, W. A.: Loss and gai of heat tolerance by the crayfish. Biol. Bull. mar. biol. Lab., Woods Hole 108, 77–87 (1955).
Thiede, W.: Über die hormonale Basis der Adaptation an extreme Temperaturen beim Schwertträger Xiphophorus helleri Haeckel (Poeciliidae, Pisces). Z. wiss. Zool. 172, 305–346 (1965).
Tsukuda, H.: Heat and cold tolerance in relation to body size in the guppy, Lebistes reticulatus J. Int. Polytech. Osaka Cy Univ. (Ser. D) 11, 43–54 (1960).
Ushakov, B. P.: Cellular resistance adaptation to temperature and thermostability of somatic cells with special reference to marine manials. Mar. Biol. 1, 153–160 (1968).
Vogel, W.: Über die Hitze- und Kälteresistenz von Zoothamnium hiketes Precht (Ciliata, Peritricha). Z. wiss. Zool. 173, 344–378 (1966).
Wolf, K. and M. C. Quimby: Established eurythermic line of fish cells in vitro. Science, N.Y. 135, 1065–1066 (1962).
Author information
Authors and Affiliations
Additional information
Communicated by O. Kinne, Hamburg
Herrn Professor Dr. H. Precht zum 60. Geburtstag gewidmet
Rights and permissions
About this article
Cite this article
Künnemann, H. Resistenzadaptation bei gehemmeter Proteinbiosynthese. Versuche mit Actinomycin D an dem Fisch Rhodeus amarus . Marine Biology 18, 260–271 (1973). https://doi.org/10.1007/BF00347788
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF00347788